Katalysator Wirkungsweise Funktionsweise sowie Aufbau
Aus den heutigen Autos ist er nicht mehr wegzudenken: Der Katalysator, seit 1989 Pflicht bei allen Neuwagen in der Bundesrepublik. Er wird eingesetzt, um die Schadstoffemissionen der Kraftfahrzeuge zu senken und dies geschieht in einem relativ komplizierten Vorgang.
 Ein Motor stößt verschiedene Schadstoffe aus, die in dem Katalysator verarbeitet werden, es geht dabei hauptsächlich um Kohlenwasserstoffe (HC-Emmisionen), Kohlenstoffmonoxid (CO) und Stickoxide (NOx). Diese werden durch eine chemische Reaktion zu Wasser, Kohlenstoffdioxid und Stickstoff oxidiert bzw. reduziert.
Ein Motor stößt verschiedene Schadstoffe aus, die in dem Katalysator verarbeitet werden, es geht dabei hauptsächlich um Kohlenwasserstoffe (HC-Emmisionen), Kohlenstoffmonoxid (CO) und Stickoxide (NOx). Diese werden durch eine chemische Reaktion zu Wasser, Kohlenstoffdioxid und Stickstoff oxidiert bzw. reduziert.
Der heute weit verbreitete 3-Wege-Katalysator kann diese Stoffe auf einmal verarbeiten, bei einer optimalen Einstellung und der richtigen Temperatur werden Konvertierungsraten von bis zu 100% erreicht, im Mittel können 90% der Schadstoffe durch den Katalysator beseitigt werden. Im Kat befindet sich ein Wabensystem aus Keramik, welches mit einer winzigen Schicht Platin bezogen ist. Dieses sorgt für den Beginn der chemischen Reaktion, die für die Reduzierung bzw. Oxidierung sorgt.
Wichtig für den einwandfreien Betrieb des Katalysators ist das Tanken von bleifreiem Benzin, ansonsten lagert sich Bleistaub im Katalysator ab und sorgt so für einen Defekt. Ein Kat funktioniert nur bei einem bestimmten Luft-Abgas Verhältnis, im Falle des 3-Wege-Kats müssen auf ein Gramm Benzin-Kraftstoff 14,7g Luft vorhanden sein, damit dieser einwandfrei funktioniert. Um diesen Vorgang zu steuern, wird eine Lambdasonde eingesetzt, die den Luftanteil genau regelt, damit eine ständige Funktion gewährleistet ist.
Aufbau des Katalysators
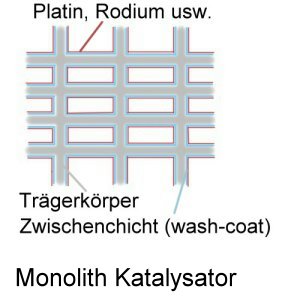 Ein Katalysator für ein Kraftfahrzeug ist immer gleich aufgebaut, lediglich die eingesetzten Materialien können sich leicht unterscheiden. Im folgendem wird auf den 3-Wege-Katalysator eingegangen, der in den meisten Benzin-Motoren eingesetzt wird. Er ist in Deutschland bereits seit 1989 Pflicht bei Neufahrzeugen.
Ein Katalysator für ein Kraftfahrzeug ist immer gleich aufgebaut, lediglich die eingesetzten Materialien können sich leicht unterscheiden. Im folgendem wird auf den 3-Wege-Katalysator eingegangen, der in den meisten Benzin-Motoren eingesetzt wird. Er ist in Deutschland bereits seit 1989 Pflicht bei Neufahrzeugen.
Innerhalb des Katalysators befindet sich ein temperaturstabiler Wabenkörper, der entweder aus Keramik oder Metallfolien besteht. Dieser Wabenkörper weist eine Vielzahl an dünnwandigen Kanälen auf. Auf dieser Oberfläche befindet sich der so genannte Washcoat, der aus Aluminiumoxid und einer Komponente zur Sauerstoffspeicherung besteht. Dies kann zum Beispiel Ceroxid sein. Die Oberfläche ist durch die poröse Struktur des Aluminiumoxid stark aufgeraut und bietet somit eine riesige Fläche (durchaus mehrere 1000m²).
Innerhalb des Washcoats befinden sich Edelmetalle, die dafür sorgen, dass die 3 Schadstoffe zu ungiftigen Stoffen reduziert werden. Früher verwendete man ausschließlich Platin, inzwischen gibt es auch Katalysatoren, die Rhodium oder Palladium benutzen. Diese beiden Metalle gehören zur Gruppe der Platinmetalle und haben sehr ähnliche Eigenschaften und wirken beinahe genauso, der entscheidende Unterschied liegt im Preis, sowohl Rhodium als auch Palladium sind deutlich günstiger zu erwerben.
Der Wabenkörper liegt in einem speziellen Metallgehäuse, das sich Canning nennt. Handelt es sich um einen Metallkatalysator, braucht kein Canning verwendet werden, in diesem Fall lässt sich der Kat einfach in den Abgasstrang einschweißen. Vor und hinter dem Katalysator befinden sich zusätzlich noch verschiedene Anschlüsse, die zum Beispiel für eine Lambdasonde verwendet werden können. Die Lambdasonde regelt die Luftzufuhr in den Katalysator und ist direkt mit der Einspritzung verbunden, damit immer ein optimales Ergebnis innerhalb des Katalysators erreicht werden kann. Ein Kat funktioniert ausschließlich mit bleifreiem Benzin, tankt man mit einem Fahrzeug mit 3-Wege-Kat verbleites Benzin über einen längeren Zeitraum, lagert sich Bleistaub im Katalysator ab und macht diesen unwirksam.
Katalysatoren in der Chemie
Katalysatoren sind in der Chemie Substanzen, die die Geschwindigkeit einer chemischen Reaktion erhöhen, indem sie die Aktivierungsenergie herabsetzen, ohne dabei selbst verbraucht zu werden. Sie beeinflussen die Kinetik einer chemischen Reaktion, aber nicht deren Thermodynamik. Der Begriff Katalysator stammt von Katalyse ab, einem griechischen Wort, das Auflösung bedeutet und eine lateinische Endung trägt.
Während einer chemischen Reaktion geht der Katalysator eine vorübergehende Verbindung mit den Ausgangsstoffen ein, wodurch eine Zwischenstufe entsteht. Nachdem das Produkt gebildet wurde, wird der Katalysator unverändert freigesetzt und kann den gleichen Vorgang in einem Zyklus wiederholt durchlaufen. Man unterscheidet zwischen homogenen Katalysatoren, wenn Katalysator und Reaktanten in derselben Phase vorliegen, und heterogenen Katalysatoren, wenn sie sich in unterschiedlichen Phasen befinden.
Die Verwendung von Katalysatoren zur Verringerung der Aktivierungsenergie ist von enormer wirtschaftlicher Bedeutung in chemischen Reaktionen. Schätzungen zufolge durchlaufen derzeit etwa 80 % aller chemischen Produkte eine katalytische Stufe in ihrer Herstellung. Die Anwesenheit des Katalysators ist entscheidend, da die jeweilige chemische Reaktion ohne ihn entweder viel langsamer oder überhaupt nicht stattfinden würde. Dadurch ermöglichen Katalysatoren effizientere und kostengünstigere Produktionsprozesse in der Industrie.
Die Bedeutung von Katalysatoren in der Automobilindustrie
Katalysatoren spielen eine entscheidende Rolle in der Automobilindustrie, da sie maßgeblich dazu beitragen, die schädlichen Emissionen von Fahrzeugen zu reduzieren und somit die Luftqualität zu verbessern. Seit ihrer Einführung in den 1970er Jahren haben Katalysatoren einen revolutionären Einfluss auf die Automobilbranche gehabt, indem sie die Abgasreinigungstechnologie zu einem unverzichtbaren Bestandteil von Fahrzeugen gemacht haben.
Die primäre Aufgabe eines Katalysators im Automobil besteht darin, die Schadstoffe in den Abgasen zu neutralisieren. Dies geschieht hauptsächlich durch die Umwandlung von giftigen und klimaschädlichen Abgasen wie Kohlenmonoxid (CO), Stickoxiden (NOx) und unverbrannten Kohlenwasserstoffen (HC) in weniger schädliche Substanzen wie Kohlendioxid (CO2), Stickstoff (N2) und Wasser (H2O). Dadurch wird die Freisetzung von gefährlichen Emissionen in die Atmosphäre erheblich reduziert.
Ein weiterer großer Vorteil von Katalysatoren ist ihre Wirksamkeit bei der Bekämpfung des sogenannten "sauren Regens". Durch die Reduktion von Stickoxiden und Schwefeldioxid im Abgas wird die Bildung von sauren Niederschlägen minimiert, die ansonsten die Umwelt, Pflanzen und Gebäude schädigen könnten.
Die Bedeutung von Katalysatoren in der Automobilindustrie spiegelt sich auch in den strengen Umweltvorschriften wider, die von Regierungen auf der ganzen Welt erlassen wurden, um die Luftqualität zu schützen. Fahrzeuge müssen bestimmte Emissionsstandards erfüllen, die ohne Katalysatoren kaum zu erreichen wären. Daher sind Katalysatoren heute eine zentrale Komponente in der Abgasreinigungstechnologie von Fahrzeugen.
Im Laufe der Jahre haben sich Katalysatoren weiterentwickelt und verbessert. Fortschritte in der Materialwissenschaft und Katalysatorentechnologie haben zu effizienteren und langlebigeren Katalysatoren geführt, die den Kraftstoffverbrauch und den Schadstoffausstoß weiter reduzieren können. Durch den Einsatz von Katalysatoren können Automobilhersteller umweltfreundlichere Fahrzeuge produzieren, die den heutigen Anforderungen an nachhaltige Mobilität gerecht werden.
Herausforderungen und Forschung im Bereich der Katalysatoren
Obwohl Katalysatoren einen integralen Bestandteil der modernen Industrie darstellen, stehen sie immer noch vor einigen Herausforderungen, die es zu bewältigen gilt. Die laufende Forschung in diesem Bereich widmet sich der Verbesserung der Katalysator-Effizienz und der Entwicklung umweltfreundlicherer Katalysatoren. Hier sind einige der aktuellen Herausforderungen und Forschungsarbeiten:
-
Ressourceneffizienz: Ein wichtiger Aspekt bei der Entwicklung von Katalysatoren ist die Ressourceneffizienz. Viele der heute verwendeten Katalysatoren enthalten seltene oder teure Metalle wie Platin, Palladium oder Rhodium. Die Sicherung der Verfügbarkeit dieser Ressourcen und die Reduzierung des Materialbedarfs in Katalysatoren sind Herausforderungen, an denen Forscher arbeiten. Neue Katalysatoren basierend auf günstigeren oder nachhaltigeren Materialien werden untersucht, um diese Abhängigkeit von kostbaren Rohstoffen zu verringern.
-
Stabilität und Lebensdauer: Katalysatoren können im Laufe der Zeit an Aktivität verlieren oder durch toxische Verunreinigungen in den Rohstoffen deaktiviert werden. Die Forschung zielt darauf ab, Katalysatoren mit längerer Lebensdauer und verbesserter Stabilität zu entwickeln, um ihre Effizienz über einen längeren Zeitraum aufrechtzuerhalten und ihre Regenerierbarkeit zu verbessern.
-
Umweltverträglichkeit: Während Katalysatoren dazu beitragen, schädliche Emissionen zu reduzieren, können einige der verwendeten Materialien und Methoden selbst umweltschädlich sein. Die Entwicklung umweltfreundlicherer Katalysatoren, die nachhaltige Herstellungsprozesse und weniger toxische Komponenten verwenden, steht im Fokus der Forschung.
-
Katalysatoren für neue Anwendungen: Mit dem Fortschreiten der Technologie entstehen neue Herausforderungen für Katalysatoren in Anwendungsbereichen wie erneuerbaren Energien, Batterietechnologien und Wasserstoffwirtschaft. Forscher arbeiten daran, maßgeschneiderte Katalysatoren zu entwickeln, die den spezifischen Anforderungen dieser neuen Technologien gerecht werden.
-
Reaktionen unter milden Bedingungen: Viele Katalysatoren erfordern hohe Temperaturen um effektiv zu arbeiten. Die Entwicklung von Katalysatoren, die bei niedrigeren Temperaturen aktiv sind, könnte die Energieeffizienz erhöhen und den Energieverbrauch reduzieren.
Weitere Arten von Katalysatoren
Cereisen (Ammoniaksynthese), Raney-Nickel, Platin, Rhodium, Palladium, Braunstein, Vanadiumpentoxid und Samarium(III)-oxid wirken als Katalysatoren bei der Dehydrierung von Ethanol.
Hopcalite, eine Gruppe von Katalysatoren bestehend aus verschiedenen Metalloxiden, katalysiert die Oxidation von Kohlenstoffmonoxid zu Kohlenstoffdioxid bei Raumtemperatur.
Der Fahrzeugkatalysator ist das bekannteste Beispiel für Katalysatoren in Automobilen, die zur Reduktion der Abgasemissionen eingesetzt werden. Das gesamte Gerät ist nach dem chemisch-physikalischen Prinzip des Katalysators benannt.
Aktivkohlewärmer verwenden Salz und Wasser als Katalysatoren und dienen als Handwärmer.
Bei Veresterungen werden saure Katalysatoren als Protonendonatoren eingesetzt. Sie fördern eine Verschiebung des chemischen Gleichgewichts während der Fischer-Veresterung zugunsten der Produkte. Bekannte Katalysatoren sind p-Toluolsulfonsäure und Schwefelsäure, aber auch Natriumhydrogensulfat kann als Katalysator wirken.
Kupferchromit oder Eisen(III)-oxid werden als Abbrandmodifikatoren in Raketenmotoren eingesetzt.
